Il primo paziente al mondo trattato con la terapia di editing genetico CRISPR personalizzata


Uno studio di riferimento condotto dal Children’s Hospital di Philadelphia e Penn Medicine mostra il potere della terapia di editing genetico personalizzata per il trattamento di pazienti con malattia metabolica rara.
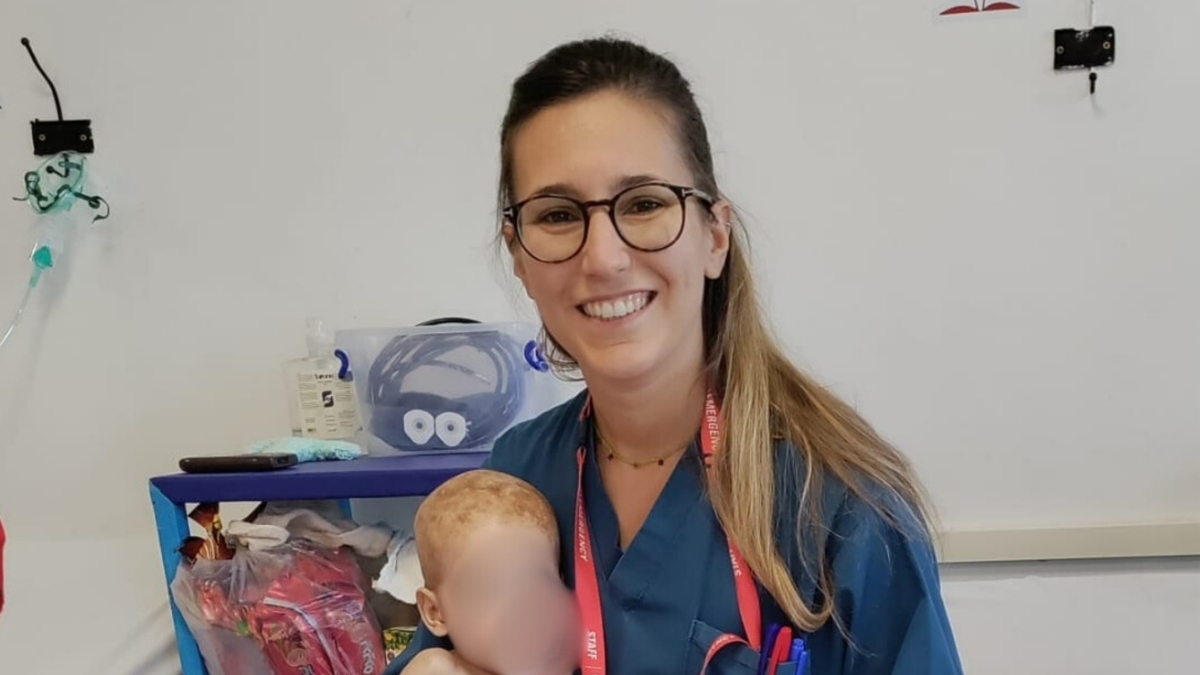
In una storica scoperta medica, un bambino a cui è stata diagnosticata una rara malattia genetica è stato trattato con successo con una terapia di editing genetico CRISPR personalizzata da un team del Children’s Hospital of Philadelphia (CHOP) e della Penn Medicine.
Il bambino, KJ, è nato con una rara malattia metabolica nota come grave deficit di carbamil fosfato sintetasi 1 (CPS1).
Dopo aver trascorso i primi mesi della sua vita in ospedale, seguendo una dieta molto restrittiva, KJ ha ricevuto la prima dose della sua terapia su misura nel febbraio 2025 tra i sei e i sette mesi di età.
Il trattamento è stato somministrato in modo sicuro e ora KJ sta crescendo bene.
Il caso è descritto in uno studio pubblicato dal New England Journal of Medicine ed è stato presentato al meeting annuale dell’American Society of Gene & Cell Therapy a New Orleans.
Questa scoperta storica potrebbe fornire un percorso per l’adattamento della tecnologia di editing genetico per il trattamento di individui con malattie rare per i quali non sono disponibili trattamenti medici.
“Anni e anni di progressi nell’editing genetico e nella collaborazione tra ricercatori e medici hanno reso possibile questo momento, e mentre KJ è solo un paziente, speriamo che sia il primo di molti a beneficiare di una metodologia che può essere scalata per adattarsi alle esigenze di un singolo paziente”, ha detto Rebecca Ahrens-Nicklas, direttore del Gene Therapy for Inherited Metabolic Disorders Frontier Program (GTIMD) presso il Children’s Hospital di Philadelphia e assistente professore di Pediatria presso la Perelman School of Medicine dell’Università della Pennsylvania.
L’editing genetico basato su CRISPR (clustered regularly interspaced short palindromic repeats) può correggere con precisione le varianti che causano malattie nel genoma umano.
Gli strumenti di editing genetico sono incredibilmente complessi e sfumati e, fino a questo punto, i ricercatori li hanno costruiti per colpire malattie più comuni che colpiscono decine o centinaia di migliaia di pazienti, come le due malattie per le quali esistono attualmente terapie approvate dalla Food and Drug Administration degli Stati Uniti, l’anemia falciforme e la beta talassemia.
Tuttavia, relativamente poche malattie beneficiano di un approccio di editing genetico “taglia unica” poiché esistono così tante varianti che causano la malattia. Anche con l’avanzare del campo, molti pazienti affetti da malattie genetiche rare, che hanno un impatto complessivo su milioni di pazienti in tutto il mondo, sono stati lasciati indietro.
Ahrens-Nicklas e Kiran Musunuru, Barry J. Gertz Professor for Translational Research presso la Perelman School of Medicine della Penn, che sono autori co-corrispondenti del rapporto pubblicato, hanno iniziato a collaborare per studiare la fattibilità della creazione di terapie di editing genetico personalizzate per singoli pazienti nel 2023, basandosi su molti anni di ricerca sui disturbi metabolici rari, nonché sulla fattibilità dell’editing genetico per il trattamento dei pazienti.
Entrambi sono membri del Somatic Cell Genome Editing Consortium, finanziato dal NIH, che supporta la ricerca collaborativa sull’editing del genoma.
Ahrens-Nicklas e Musunuru hanno deciso di concentrarsi sui disturbi del ciclo dell’urea.
Durante la normale scomposizione delle proteine nel corpo, l’ammoniaca viene prodotta naturalmente. In genere, il nostro corpo sa convertire l’ammoniaca in urea e quindi espellere quell’urea attraverso la minzione.
Tuttavia, un bambino con un disturbo del ciclo dell’urea manca di un enzima nel fegato necessario per convertire l’ammoniaca in urea.
L’ammoniaca si accumula quindi fino a raggiungere un livello tossico, che può causare danni agli organi, in particolare nel cervello e nel fegato.
Dopo anni di ricerca preclinica con varianti simili che causano la malattia, Ahrens-Nicklas e Musunuru hanno preso di mira la variante specifica di CPS1 di KJ, identificata subito dopo la sua nascita.
Nel giro di sei mesi, il loro team ha progettato e prodotto una terapia di editing di base somministrata tramite nanoparticelle lipidiche al fegato al fine di correggere l’enzima difettoso di KJ.
Alla fine di febbraio 2025, KJ ha ricevuto la sua prima infusione di questa terapia sperimentale e da allora ha ricevuto dosi di follow-up a marzo e aprile 2025.
Nell’articolo appena pubblicato sul New England Journal of Medicine, i ricercatori, insieme ai loro collaboratori accademici e industriali, descrivono la terapia di editing genetico CRISPR personalizzata che è stata sviluppata in modo rigoroso ma rapido per la somministrazione a KJ.
Ad aprile 2025, KJ aveva ricevuto tre dosi della terapia senza gravi effetti collaterali.
Nel breve tempo trascorso dal trattamento, ha tollerato un aumento delle proteine alimentari e ha avuto bisogno di meno farmaci anti-azoto.
È stato anche in grado di riprendersi da alcune malattie tipiche dell’infanzia come il rinovirus senza che l’ammoniaca si accumuli nel suo corpo. È necessario un follow-up più lungo per valutare appieno i benefici della terapia.
“Mentre KJ dovrà essere monitorato attentamente per il resto della sua vita, i nostri risultati iniziali sono piuttosto promettenti”, ha detto Ahrens-Nicklas.
“Vogliamo che ogni singolo paziente abbia il potenziale per sperimentare gli stessi risultati che abbiamo visto in questo primo paziente, e speriamo che altri ricercatori accademici replichino questo metodo per molte malattie rare e diano a molti pazienti una possibilità equa di vivere una vita sana”, ha detto Musunuru.
“La promessa della terapia genica di cui abbiamo sentito parlare per decenni sta arrivando a compimento e trasformerà completamente il modo in cui ci avviciniamo alla medicina”.
In genere, i pazienti con deficit di CPS1, come KJ, vengono trattati con un trapianto di fegato.
Tuttavia, affinché i pazienti possano ricevere un trapianto di fegato, devono essere stabili dal punto di vista medico e abbastanza grandi da gestire una procedura così importante.
Durante questo periodo, gli episodi di aumento dell’ammoniaca possono mettere i pazienti a rischio di danni neurologici continui e permanenti o addirittura rivelarsi fatali.
A causa di queste minacce alla salute per tutta la vita, i ricercatori sapevano che trovare nuovi modi per trattare i pazienti troppo giovani e piccoli per ricevere trapianti di fegato avrebbe cambiato la vita delle famiglie i cui figli affrontavano questo disturbo.
“Avremmo fatto qualsiasi cosa per i nostri figli, quindi con KJ, volevamo capire come lo avremmo sostenuto e come avremmo potuto portarlo al punto in cui poteva fare tutte le cose che un bambino normale dovrebbe essere in grado di fare”, ha detto sua madre, Nicole Muldoon.
“Abbiamo pensato che fosse nostra responsabilità aiutare nostro figlio, quindi quando i medici sono venuti da noi con la loro idea, abbiamo riposto la nostra fiducia in loro nella speranza che potesse aiutare non solo KJ ma anche altre famiglie nella nostra posizione”.
“Siamo stati nel bel mezzo di tutto questo da quando KJ è nato, e tutto il nostro mondo ha ruotato attorno a questo piccoletto e alla sua permanenza in ospedale”, ha detto suo padre, Kyle Muldoon.
“Siamo così entusiasti di poter finalmente stare insieme a casa in modo che KJ possa stare con i suoi fratelli e possiamo finalmente fare un respiro profondo”.
Foto: Children’s Hospital of Philadelphia
The post Il primo paziente al mondo trattato con la terapia di editing genetico CRISPR personalizzata appeared first on Cronache di Scienza.
Qual è la tua reazione?
 Mi piace
0
Mi piace
0
 Antipatico
0
Antipatico
0
 Lo amo
0
Lo amo
0
 Comico
0
Comico
0
 Furioso
0
Furioso
0
 Triste
0
Triste
0
 Wow
0
Wow
0
































































































































-1765810901947.jpeg--vigili_del_fuoco_in_corsia__donazione_e_sorrisi_per_i_piccoli_pazienti.jpeg?1765810902230#)


































![[SPOILER] Sandokan anticipazioni Lunedi 15 Dicembre: Una penultima puntata da non perdere!](https://images.everyeye.it/img-notizie/-spoiler-sandokan-anticipazioni-lunedi-15-dicembre-penultima-puntata-non-perdere-v3-848485-800x600.webp?#)




-1765811392801.jpg--_il_tango_delle_capinere___foto_di_scena_di_rosellina_garbo.jpg?1765811392999#)























-1754133631392.png--valerio_minato_svela_il_volto_in_movimento_del_monviso_sotto_le_stelle.png?1754133631616#)